日报标题:电源的原理是什么,还得从水果能发电说起
 Patrick Zhang,电气工程师
Patrick Zhang,电气工程师
这个问题和电极电位有关。
看下图:

图中的西红柿电池,电压有 12.12V?苦笑脸,到底是 12.12V 还是 12 时 12 分?
为何西红柿能发电?这是金属元素的电极电位在起作用。不过,西红柿电池的持续工作能力估计有限,不知道能否给手机应急充电?
打开《无机化学》,我们在氧化还原的章节中能看到金属的活动特性顺序,如下:
K、 Ca、 Na、 Mg 、Al 、Zn、 Fe 、Sn 、Pb、 (H) 、Cu、 Hg 、Ag 、Pt、 Au。
在酸性溶液的条件下,元素会氧化,例如铜,它会被氧化成为 。铜氧化后,与基底的铜形成了电势差,这种电势差叫做电极电位。其方程式如下:
注意,方程式左边是铜的氧化态,右边是它的还原态。从右边的元素变成左边的状态叫做氧化,反过来叫做还原。
我们看到,铜原子丢失了两个电子后,就形成了它的氧化态。这样一来,铜的氧化态与基底铜之间就会形成一个电压,叫做电极电位。
在酸性溶液中,元素的电极电位表如下:

这张表中,左边是某元素的氧化状态变化,中间是反应式,右边是电势差。
注意到一个重要的参照,就是氢,在上表的最底部,它的电极电位为零。其它所有元素的电极电位值都是参照 H 的电极电位来给定的。
注意到二价铜的电极电位是 0.3419V,二价锌的电极电位是 -0.7618V,我们把两者放在一起,会怎样呢?
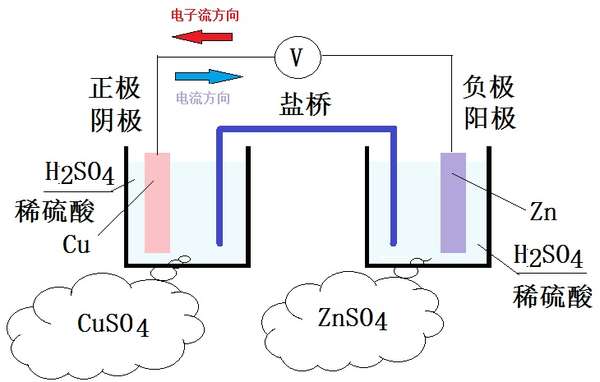
注意,图中左边是铜电极,右边是锌电极。
由于铜的电极电位比锌要高,所以电子流不断地从锌电极流入铜电极,铜离子得到电子后被还原,而更多的锌被氧化,也即锌原子的氧化数不断地持续升高。其结果就是锌被腐蚀掉了,直到锌电极完全被腐蚀光,反应才停止。
由于铜的电极电位是 0.3419V,锌的电极电位是 -0.7618V,于是电池的电动势 E 为:
这就是锌和铜的电池反应。
其中,左右两边都叫做半反应。它们的反应式为:
左边:
右边:
注意到一个很有意义的问题:
我们都知道,铜导线在自然情况下表面会发黑,这是它的氧化,铜的表面会生成
对。如果有水汽沾染,则会进一步与二氧化碳反应生成铜绿,即 Cu₂(OH)₂CO₃,一种固态物质。
我们知道,化学反应进行到底的条件是生成气体或者难溶的固体物质。当铜生成铜绿后,铜就会不断地受到持续性的腐蚀。
如果我们在铜的表面镀上一层锡,而锡的电极电位和铜的电极电位有如下关系:
查看金属元素的活泼性,我们发现锡排在铜的左边,所以锡比铜活泼。结果,锡就会不断地被腐蚀掉,而铜则不断地得到还原。
在这里,锡成为牺牲元素。
在实际的电路中,铜的表面镀锡十分常见。不管是导线,继电器触头导电杆,还是集成电路的表面,还有母线表面,常常见到铜镀锡。如果我们不希望锡成为牺牲元素,那么该怎么办?
请记住这种现象的名称:金属材料的电化学腐蚀。
为了避免让锡成为牺牲元素,就必须在铜上完整地镀上锡,并且不能有破口。否则,就一定会让锡成为牺牲元素。
反过来,如果我们在铜的表面镀上一层银,或者镀上一层铬,如果镀层没有镀满,或者有破口,则因为铜比两者都活泼(见金属活动顺序表)。则铜将会受到持续性腐蚀。